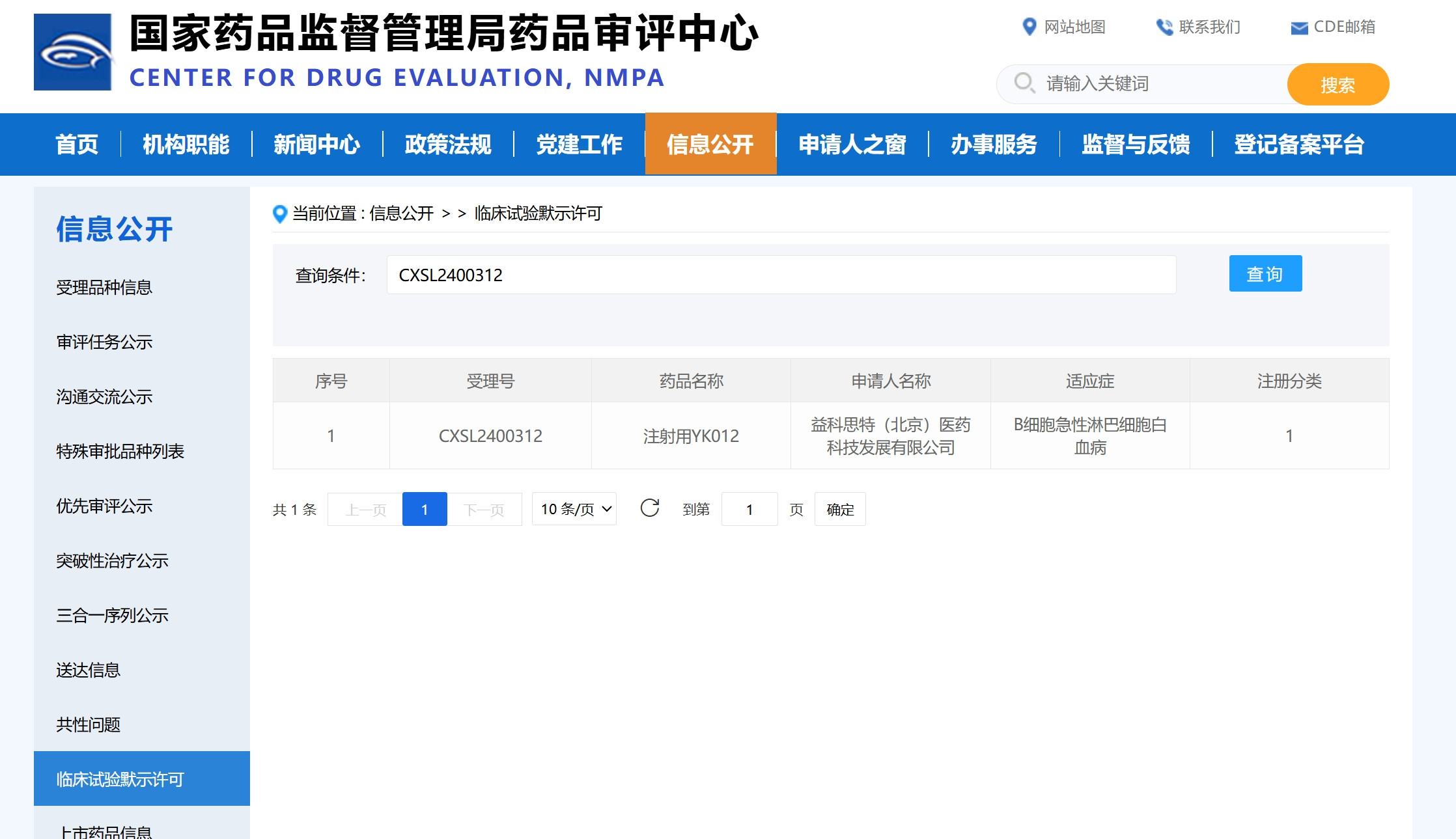
益科思特創(chuàng)新型雙特性抗體YK012 又新添一適應(yīng)癥——B細胞急性淋巴細胞白血病(B-ALL )
2024年7月22日,,益科思特(北京)醫(yī)藥科技發(fā)展有限公司自主研發(fā)的雙特異性抗體YK012(受理號:CXSL2400312),,正式獲得國家藥品監(jiān)督管理局藥品審評中心的藥物臨床試驗(IND)批準,用于治療B細胞急性淋巴細胞白血?。˙-ALL),。本次獲批開展一項評價YK012治療B細胞急性淋巴細胞白血病的安全性、耐受性,、藥代動力學(xué)特征和初步抗腫瘤療效的多中心,、開放性、Ib/Ⅱ期臨床研究,。
YK012是一款靶向CD19/CD3的創(chuàng)新型雙特異性抗體,,是繼2022年獲批 “復(fù)發(fā)/難治B細胞非霍奇金淋巴瘤”適應(yīng)癥后擴展的第二個適應(yīng)癥,是益科思特獲得的第三個IND批準,,標志著益科思特的創(chuàng)新型雙特異性抗體的研發(fā)技術(shù)穩(wěn)步走向成熟,,逐漸經(jīng)歷臨床研究的考驗,有望最終轉(zhuǎn)化為產(chǎn)品,。
益科思特YK012是采用創(chuàng)新型免疫雙特異性抗體質(zhì)量源于設(shè)計(Quality by Design )的理念,,基于益科思特獨具優(yōu)勢特色的FIST平臺進行開發(fā)的靶向CD19/CD3的雙特異性抗體,,是I類創(chuàng)新藥物,定位為同類最佳(Best in class),。YK012與安進公司的貝林托歐單抗具有相似作用機理,,但在分子結(jié)構(gòu)、半衰期,、生產(chǎn)水平以及毒性方面均顯著優(yōu)于貝林托歐單抗,。YK012的NHL的I期臨床研究已有15例患者接受治療。截止當(dāng)前,,藥物的安全性和耐受性良好,,盡管還在劑量爬坡階段,但已經(jīng)觀察到一些病例的腫瘤縮小現(xiàn)象,。特別是在腫瘤負荷較重的患者中,,通過多次給藥,仍然可以展現(xiàn)療效,。綜合臨床前和臨床階段的研究結(jié)果表明,,YK012可能具有更好的臨床療效和安全性,有望為難治和/或復(fù)發(fā)的ALL,、NHL和自身免疫性疾病提供更好的選擇,。
益科思特(北京)醫(yī)藥科技發(fā)展有限公司由來自著名美國制藥企業(yè)回國人員袁清安博士和孟慶武先生共同創(chuàng)立,在中美兩地設(shè)有研發(fā)中心,。公司充分利用中美兩國的信息優(yōu)勢、技術(shù)優(yōu)勢和人才優(yōu)勢,,致力于全球創(chuàng)新藥物的研發(fā),,針對血癌、多發(fā)性骨髓瘤,、三陰乳腺癌,、肝癌和自身免疫性疾病等創(chuàng)新型雙特異抗體藥物的開發(fā),多個項目具有長效,、低毒,、高產(chǎn)的技術(shù)創(chuàng)新特點,均為國際對標產(chǎn)品的更新?lián)Q代產(chǎn)品,。公司擁有完備的技術(shù)團隊和管理團隊,,具備從初步構(gòu)想到規(guī)模化生產(chǎn)的全鏈條技術(shù)平臺,。益科思特憑借其創(chuàng)新的雙抗技術(shù)平臺和高效的研發(fā)團隊,,已獲得多項榮譽和資助。益科思特創(chuàng)新藥物的研發(fā)均為全球布局,,首個雙特異抗體產(chǎn)品已取得國內(nèi)外專利證書,,并已獲得國家藥品監(jiān)督管理局臨床批件(編號2022LP00654,、2024LP01666),NHL的I期臨床進行中,ALL適應(yīng)癥的Ib/II期啟動在即,,治療兩個自身免疫性疾病的Pre-IND已經(jīng)遞交,。第二個雙特異抗體產(chǎn)品已取得相關(guān)專利證書,并已獲得國家藥品監(jiān)督管理局臨床批件(編號2024LP008),,6月份第1例患者已入組,。第三個產(chǎn)品已完成3批中試生產(chǎn),預(yù)計2024年底申報新藥臨床,。其他管線產(chǎn)品包括全球創(chuàng)新的靶點雙抗藥物研發(fā)均在有序推進中,。
目前,公司正積極推進多個臨床項目,,并與國際知名機構(gòu)進行商業(yè)合作洽談,,未來有望在全球市場上取得更大的突破。
益科思特秉承行醫(yī)治,,行拯救為醫(yī)藥人的使命和責(zé)任,,不斷推出1.1類新藥進入臨床研究,力爭早日獲批新藥產(chǎn)品進入國際國內(nèi)市場,,使患者獲益,,擁抱健康。

